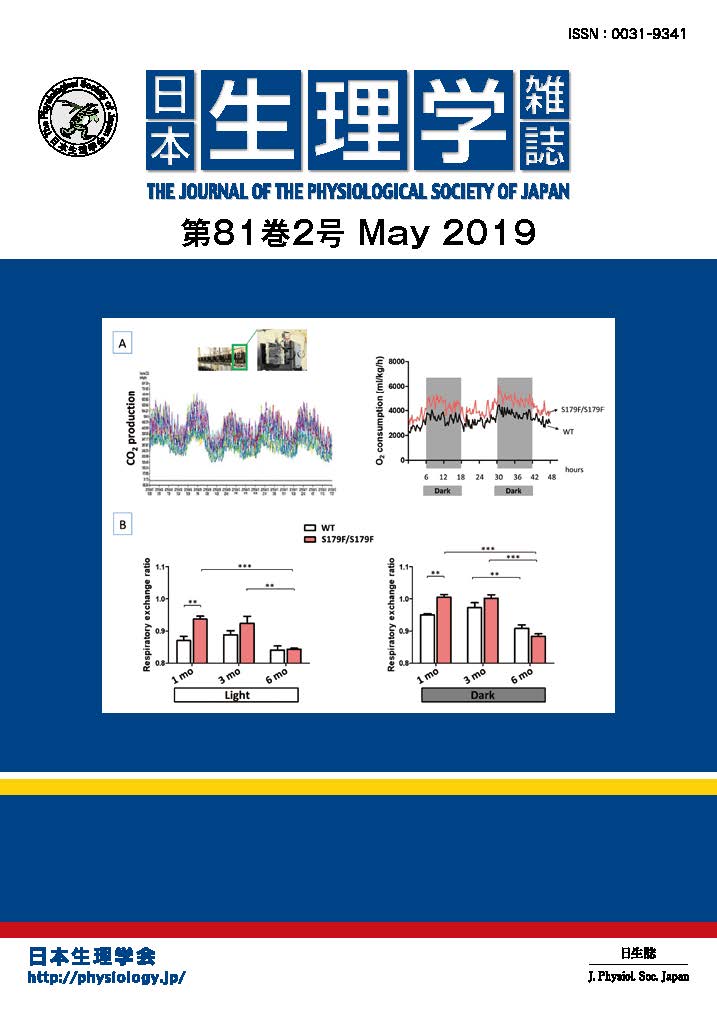
副腎皮質からのグルココルチコイド分泌は、視床下部室傍核の副腎皮質刺激ホルモン放出ホルモン(CRH)によって下垂体から副腎皮質刺激ホルモン(ACTH)の分泌が促進されることによって促進されるという、いわゆる視床下部―下垂体―副腎系(HPA axis)で調節されます。HPA axisはさらに、視床下部と下垂体のレベルで各々グルココルチコイドによるネガティブフィードバックによる調節を受けます。非ストレス状態においては、CRHニューロンは、γ-aminobutyric acid (GABA) ニューロンの室傍核への入力によって抑制性の制御を受けています。GABAが抑制性に働くためには細胞内Cl-濃度が低いことが必要であり、室傍核のCRHニューロンの細胞体においては、K+-Cl–共輸送体 (KCC2: Cl–汲み出し機能)の発現によって細胞内Cl–濃度が低く保たれています。一方で、急性ストレス時にはCRHニューロン細胞体におけるKCC2の細胞膜での発現が低下することによって細胞内Cl–濃度が上昇し、CRHニューロンに対するGABA作用がCl–流入による抑制性からCl–流出による興奮性に変化することが近年示されました。
本研究では、GABA合成量が半減したマウス(GAD67-GFP knock-in, ヘテロ)を用いて検討したところ、非ストレス状態でもGABAの減少により、CRH放出が減少して細胞体に蓄積している可能性が示唆されました。そこで、CRH放出部位である視床下部正中隆起のCRHニューロン軸索終末に着目したところ、終末にはGABAA受容体とともに細胞内にCl–を取り込むNa+-K+-2Cl–共輸送体(NKCC1)が発現しており、小胞性GABAトランスポーターとも共局在していました、しかし室傍核にあるCRHニューロン細胞体とは対照的にKCC2は発現していませんでした。さらに、逆行性トレーサーによりGABA作動性線維の投射元を探索したところ、視床下部の弓状核でした。ついで、CRH-CreマウスとCa2+感受性蛋白GCaMP3レポーターマウスを交配し、CRHニューロン選択的にGCaMP3を発現するマウスを作製してGABA作用を調べたところ、細胞体では細胞内Ca2+が減少したのに対し、終末では有意に増加しました。すなわち、CRHニューロン軸索終末はNKCC1発現により細胞内Cl–濃度が高く、弓状核から投射するGABAが興奮性に作用してCRH分泌を促進するという、ストレスホルモン放出機構の新しい経路を発見しました(図)。
弓状核は、摂食行動制御の中心であり、摂食行動を促進するニューロペプチドY (NPY)/アグーチ関連ペプチド(AgRP)を産生するニューロンと、摂食行動を抑制するα-メラノサイト刺激ホルモン(α-MSH)を産生するプロオピオメラノコルチン(POMC)ニューロンが存在し、室傍核への投射などを介して相反的な働きをしており、摂食行動やエネルギー代謝に重要であることが知られています。このうちAgRP/NPYニューロンがGABA作動性で、他にrat insulin promoter (RIP)ニューロンもGABA作動性で、何れも血中のインスリンやレプチン、グレリンなどを介して栄養状態をモニターしているので、摂食行動に伴うグルココルチコイドの変化に今回発見した機構が関与している可能性があります。さらに、AgRP/NPYニューロンにはグルココルチコイド受容体が発現することも知られており、もしかすると、栄養や代謝状態によるHPA axisへのネガティブフィードバックループを形成している可能性もあり(図)今後更に検討していく必要があります。
Keisuke Kakizawa, Miho Watanabe, Hiroki Mutoh, Yuta Okawa, Miho Yamashita, Yuchio Yanagawa, Keiichi Itoi, Takafumi Suda, Yutaka Oki, Atsuo Fukuda*: A novel GABA-mediated corticotropin-releasing hormone secretory mechanism in the median eminence. Science Advances 2: e1501723, 2016.*corresponding author
図.従来の視床下部室傍核―下垂体―副腎系(HPA axis)と今回新たに見つかった視床下部弓状核―正中隆起の興奮性GABA誘発性CRH放出を加えた栄養や代謝状態によるHPA axisへのネガティブフィードバックループ。