CONTENTS
- カテゴリーなし - 目次
- VISION - “ology”を教えよう(小西真人) P.267~
- OPINION - JPS の現況 (佐久間康夫) P.268~
- SCIENCE TOPICS - 脳は早いニオイ情報と,遅いが精度の高いニオイ情報を別々の経路で処理する (五十嵐啓) P.270~
- SCIENCE TOPICS - 心肥大シグナル分子カルシニュリンの制御に関わる意外なpHysiology (久光 隆) P.270~
- EDUCATION - スポーツ科学部で生理学をいかに教えるか? (彼末一之) P.272~
- AFTERNOON TEA - 下川哲昭 「研究の推進と学生の力」 P.275~
- AFTERNOON TEA - 岩室宏一 「ニューロンと闘牛の神経科学」 P.275~
- AFTERNOON TEA - 辻野なつ子 P.275~
- ACTIVITIES - 若手の会運営委員の活動 (上窪裕二) P.279~
- RECORDS - 第24 回日本生理学会将来計画委員会議事録 P.281~
- 特集/SYMPOSIA - 若手の会運営委員会シンポジウム (S1) P.283~
- 特集/SYMPOSIA - TRP チャネルの産業応用 (S5) P.283~
- 特集/SYMPOSIA - 心筋のE-C カップリング(S10 Pt 2):心筋カルシウムシグナル異常の統合的システムバイオロジー P.283~
- 特集/SYMPOSIA - 平滑筋組織の間質に分布する各種細胞の生理機能 (S23) P.283~
- 特集/SYMPOSIA - MD-PhD シンポジウム:研究志向学生の育成を目指して (S24) P.283~
- 特集/SYMPOSIA - 新たにわかった褐色脂肪の生体機能とそのメカニズム (S31) P.283~
- 特集/SYMPOSIA - 生理学・生理学会大会の今日的役割: 多分野の交流と連携を訪ねて (S40) P.283~
- 特集/SYMPOSIA - 体液調節の新たな展開―分子から行動まで― (S46) P.283~
- カテゴリーなし - 編集後記
表紙の説明
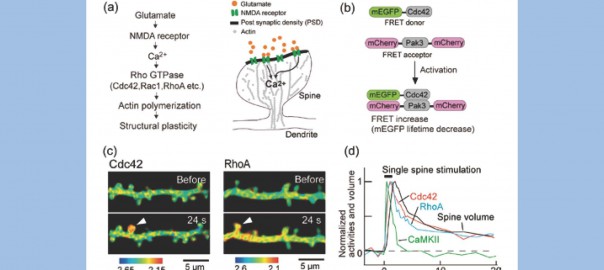
第89 回日本生理学会大会(長野)
演題番号:1PJ-77
演題「海馬神経細胞上のスパイン内でのRho GTPase 活性化イメージング」
“Imaging Rho GTPases activation in single dendritic spines of hippocampal neurons”
演者:村越秀治1,2,安田涼平3
所属:1生理学研究所 脳機能計測・支援センター, 2科学技術振興機構さきがけ, 3Howard Hughes Medical Institute, Duke University Medical Center
神経回路の形成,機能の基礎となるシナプス結合の可塑性は,シナプスの後端を形成するスパイン内のカルシウムシグナルによって制御されていると考えられるが,スパインのサイズは0.1 fL 程度と非常に小さく,しかも組織深部に位置するため,内部で起こるシグナル伝達は,これまで殆ど明らかにされてこなかった.しかし最近,2 光子蛍光寿命イメージング法の進歩により,組織深部で分子同士の相互作用や活性を可視化することが可能になった.我々はこの方法を用いて,海馬組織中のスパイン内で低分子量Gタンパク質RhoGTPase の活性化を可視化することに成功し,これらの分子がシナプス可塑性を引き起こすために必須であることを明らかにした.
(a)(左)Rho GTPaseに関わるシグナル伝達カスケード.スパイン内でのCa2+ 濃度が上昇すると,Rho GTPase が活性化しアクチンの重合や脱重合を促進する.(右)スパインの模式図.シナプス後部(樹状突起側)にあるマッシュルーム様の構造がスパイン.
(b) Cdc42 FRET センサーの模式図.単量体GFP を融合させたCdc42 をFRET のドナーとし,下流のシグナル分子であるPak3 の活性化Cdc42結合ドメインにmCherry を2つ融合させたものをアクセプターとした.
(c) Cdc42 とRhoA のスパイン刺激後の蛍光寿命イメージ.暖色(蛍光寿命が短い方)は活性が高いことを示す.FRET センサーを発現した神経細胞の樹状突起上の1個のスパインを刺激して長期増強を誘起したところ,スパインの体積増加と共に,非常に大きなCdc42 とRhoA の活性化(FRET の増加)が見られた.興味深いことに,Cdc42 とRhoA は構造が非常に似ているにも拘わらず,空間的に異なる活性分布を示した.すなわち,Cdc42 の活性はスパインに限局しており,RhoA の活性は樹状突起へと広がっていた(図1c).
(d)アンケイジング刺激後のシグナル分子活性化とスパインの体積変化のタイムコース.薬剤処理やshRNA を用いてCdc42,あるいはRhoA の活性を阻害したところ,RhoA の活性化はスパイン体積増大のトリガーとして,また,Cdc42 は体積増大を維持するためのメモリー分子として機能していることが明らかになった.