CONTENTS
- ABSTRACTS - 日本生理学会北海道地方会 (第86回北海道医学大会生理系分科会) P.236~
- CALENDAR - 主な研究集会日程 P.234~
- RECORDS - 感覚合同グループディナー報告 (河村 悟,倉橋 隆) P.233~
- RECORDS - 第2回「生理学教育を語る会」報告(松尾 理,渋谷まさと) P.232~
- INFORMATION - 沖縄科学技術大学院大学 先行研究プロジェクト研究員,技術員募集 P.227~
- INFORMATION - 第32回組織細胞化学講習会 P.227~
- INFORMATION - 第59回目本生理学会中国四国地方会 P.227~
- INFORMATION - 千里ライフサイエンス技術講習会 第46回 「選抜アレイとリアルタイムPCRの拓く新たな地平」 P.227~
- INFORMATION - 第15回日本発汗学会総会のご案内 P.227~
- INFORMATION - 特定領域研究「細胞感覚」夏のシンポジウム2007 P.227~
- INFORMATION - 関西学院大学理工学部生命科学科教員公募 P.227~
- INFORMATION - 財団法人光科学技術研究振興財団研究助成と表彰の募集 P.227~
- AFTERNOON TEA - 塩沢友規「ナツミ」 P.222~
- AFTERNOON TEA - 美藤純弘 P.222~
- AFTERNOON TEA - 橋本道男「日本のチベットから世界に発信する研究を夢見て」 P.222~
- PROFILE - 勢井宏義 P.218~
- SCIENCE TOPICS - ペンゾジアゼピンのミダゾラムによる大脳皮質第V層のGABA作動性シナプスにおけるα7 ニコチン受容体の誘導 (山本純倖) P.217~
- VISION - 「生理学が重要」ってどういうこと? (明間立雄) P.215~
表紙の説明
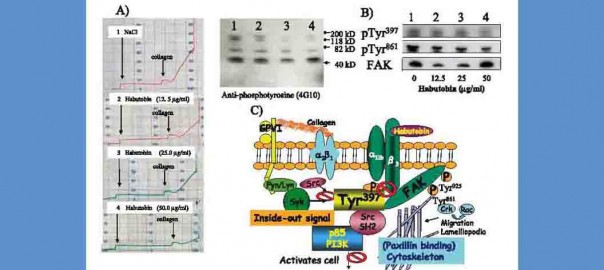
第84回日本生理学会大会(大阪)
演題番号:3PIA−038
演題:「ハブトビンは,血小板凝集初期のFAK−Tyr397リン酸化を抑制する」“Habutobin inhibited the phosphorylation of Tyr397 of FAK at an early stage of collagen induced platelet aggregation”
演者: 中村真理子,吉岡美和,中村一直,砂川昌範,小杉忠誠
所属: 流球大学 医学部 形態機能医科学講座 生理学第一分野
ハブトビンは,1986年に小杉らにより発見されたハブ毒由来のトロンビン様酵素で,家兎のフィブリノーゲンをフィブリンヘ変換する際,フィブリノペプタイドAのみを遊離する,Type A−トロンビン様酵素である.これまでの研究では,ハブトビンが血小板膜上のintegrinβ3に結合する.また,コラーゲン凝集時のLagtimeの延長と,凝集抑制を引き起こすのを報告した.本研究は,血小板内伝達機構に着目し,血小板内チロシンリン酸化を中心に,ハブトビンによるコラーゲン磯集抑制機序を推察した.図中の1-4は,1:ハブトビン非添加,2:ハブトビン(12.5μg/ml)添加,3:ハブトビン(25μg/ml)添加,4:ハブトビン(50μg/ml)添加をそれぞれ示す.
(A)ハブトビン非添加に比較して,ハブトビン添加では,ハブトビン濃度依存性にコラーゲン凝集時のLag timeの延長と,擬集率の減少が見られた.同時期の血小板内蛋白のチロシンリン酸化は,ハブトビンの濃度依存性に120kDaのチロシンリン酸化蛋白の消失がみられた.FAK抗体を用いた免疫沈降法により,消失した蛋白の本体はFAKと判明した.
(B)FAKの免疫沈降試料では,ハブトビン濃度依存性にFAK−Tyr397リン酸化の抑制が見られた.文献より,integrinβ3の細胞内ドメインにFAK−Tyr397の結合部位は存在すると報告されている.
(C)ハブトビンの擬集抑制機序は以下のように推察した.すなわち,ハブトビンがintegrinβ3へ結合するによりFAK−Tyr397の位置や構造が変化し,その下流に存在するSH2やPI3K(p85)のリン酸化が引き起こす細胞骨格変化が遅延し,血小板凝集を引き起こすためのLag timeの延長が生じ,凝集抑制が引き起こされる.