心筋の静止電位を決定し、活動電位の最終相で速やかな再分極を引き起こすのは、心臓ではIK1と呼ばれる強い内向き整流性を示すカリウムイオン(K+)電流です。細胞外K+濃度が変化すると、この電流を担うチャネルのK+透過性は細胞外K+濃度のほぼ平方根に比例して増減するため、再分極を引き起こす外向きのIK1電流は細胞外K+の増加によって増え、K+の減少によって減るというK+濃度勾配に一見矛盾する変化を示します。この現象は、この電流の膜電位依存性がK+の平衡電位とともに移動する性質と共に、血清K+濃度の増加/減少が心室再分極を促進/遅延する主な理由ですが、そのメカニズムはよく分かっていませんでした。
本研究では、IK1を担うKir2.1チャネルについて、細胞質側の溶液からポリアミンを除くことによって内向き整流性を示さなくなった電流の細胞外K+濃度依存性を検討しました。その結果、このチャネルのK+透過性に細胞外K+の存在は必要では無いこと、さらにK+透過性が細胞外K+濃度の増減に比例するのは、細胞外Na+が非常に速いキネティクスで細胞外K+と競合的にイオン透過路をブロックするためであることが分かりました。すなわち、細胞外K+の増加/減少は、細胞外Na+によるK+透過の抑制を減少/増加させることによって外向きのK+透過を増加/減少させます。本研究により、高/低カリウム血症と心室再分極速度の関係、すなわち心電図T波の狭高/平低化に対する分子レベルの説明が得られました。
External K+dependence of strong inward rectifier K+channel conductance is caused not by K+but by competitive pore blockade by external Na+.
Keiko Ishihara. Journal of General Physiology. 150(7): 977-989, 2018.
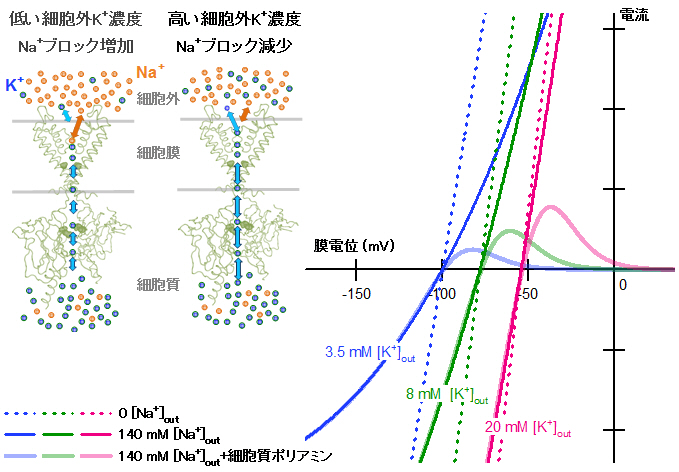
細胞外Na+によるブロックのパラメーターを用いて再現された内向き整流性K+電流の細胞外K+濃度([K+]out)依存性
左:細胞外Na+は内向き整流性K+チャネルのK+透過路を外側から早いキネティクスでブロックする。細胞外Na+によるブロックは細胞外K+と競合するので、[K+]out増加はNa+ブロックを減少させて、外向き、内向き両方向のK+透過が増加する。
右:内向き整流性K+電流の電流―電圧関係の[K+]out依存性の再現(青、3.5mM;緑、8mM;マゼンタ、20mM)。
細胞外Na+が存在しないと(0[Na+]out)、ポリアミンブロックの無い電流―電圧関係は直線に近く、その傾き(コンダクタンス)は[K+]outが変化してもほとんど変わらない(濃い色の点線)。しかし、細胞外Na+が存在すると(140mM [Na+]out)、 [K+]outが低いほどNa+ブロックが増強してコンダクタンスが小さくなる(濃い色の実線)。ポリアミンブロックによって内向き整流性(外向き電流抑制)を示す電流―電圧関係においても、[K+]outの減少/増加は、ポリアミンブロックの無いチャネルに対する細胞外Na+ブロックを増強/抑制することで電流振幅を変化させる(薄い色の実線)。