AMPA受容体は脳での興奮性シナプス伝達を担うタンパク質です。これまで、信号を受け取ったシナプスの後部にAMPA受容体が集合することで、神経伝達の効率が高まると考えられてきました。しかし、AMPA受容体がシナプス後部に集合するメカニズムは分かっていませんでした。今回の研究では、高速原子間力顕微鏡を用いて、AMPA受容体の細胞外ドメインがどのように動くのか観察しました(図左)。その結果、これまで強固と考えられていた細胞外ドメインの二量体(ダイマー)は大きく揺れ動いているだけではなく、分裂(図中)と結合を繰り返すことが明らかになりました。さらに、分裂したダイマーが近隣のAMPA受容体と互いに結びつく様子(ダイマー交換)も観察され(図右)、「ダイマー交換」がAMPA受容体のシナプスへの集合を促すメカニズムの一部であることが明らかになりました。
AMPA受容体はてんかん発作と関連がある分子であり、その動作を阻害する薬剤が治療方法として重要視されています。したがって、本研究の結果は、興奮性神経伝達の分子メカニズムに新たな知見を与えるだけではなく、関連する疾患に対する画期的な治療薬の創出にも寄与すると期待されます。
High-Speed Atomic Force Microscopy Reveals Fluctuations and Dimer Splitting of the N-Terminal Domain of GluA2 Ionotropic Glutamate Receptor-Auxiliary Subunit Complex.
Sumino A, Sumikama T, Zhao Y, Flechsig H, Umeda K, Kodera N, Konno H, Hattori M, Shibata M.
ACS Nano 巻(号): ppp-ppp, 2024. 巻号頁未定
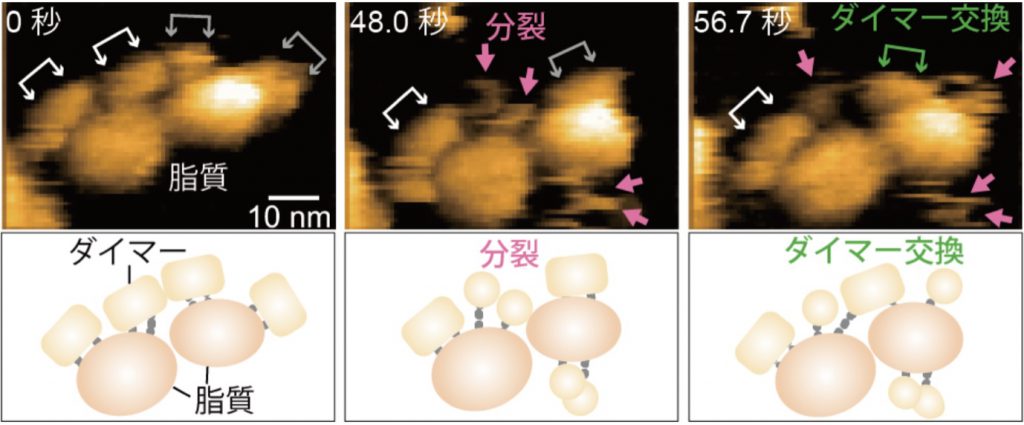
<図の説明>
高速原子間力顕微鏡で観察されたAMPA受容体の細胞外ドメインの動き(上)と模式図(下)。