心臓にはIKsと呼ばれる非常に遅い遅延整流性カリウム電流が存在しており、そのユニークな性質が心臓の興奮性制御に重要な役割を果たしています。このIKs電流はKCNQ1と呼ばれるカリウムチャネルαサブユニットと、それを修飾するKCNE1と呼ばれるサブユニットのイオンチャネル複合体によって担われていると考えられています。KCNQ1単独でもカリウム電流を構成することはできますが、KCNE1を共発現させると、電流の増大に加え、著しい活性化・不活性化速度の低下と脱分極側への大きな電位依存性のシフト(約40 mV)が起きます。すなわち、KCNE1存在下ではKCNQ1チャネルが開きにくくなるのですが、その分子メカニズムはまだよくわかっていませんでした。
今回の研究で我々は、KCNE1の存在下において、KCNQ1チャネルの電位センサーであるS4セグメント上に存在する232番目のフェニルアラニン(Phe232)と、隣接するポアドメインS5セグメント上にある279番目のフェニルアラニン(Phe279)が非常に近い位置関係にあり、電位センサーが細胞の外側に向かって動く際(チャネル活性化時)、両者がぶつかることでKCNQ1チャネルを開きにくくしていることを見出しました。さらに、Voltage-clamp fluorometry法を適用することで電位センサーの動きとカリウムイオン電流を同時に測定したところ、電位センサーが上がったのちチャネルが開状態に入るステップが、この2つのフェニルアラニンの衝突により遅くなっているという結果を得ました。
以上の結果は、KCNE1の存在が、KCNQ1の電位センサーとポアのドメイン間相互作用を変化させることで開きにくいチャネルに変化させていることを示しています。比較的大きなアミノ酸であるフェニルアラニン残基による“出っ張り”が、このドメイン間相互作用に重要な役割を果たしていると考えられます。
Nakajo, K. & Kubo, Y. Steric hindrance between S4 and S5 of the KCNQ1/KCNE1 channel hampers pore opening. Nature Communications 5:4100, doi: 10.1038/ncomms5100 (2014).
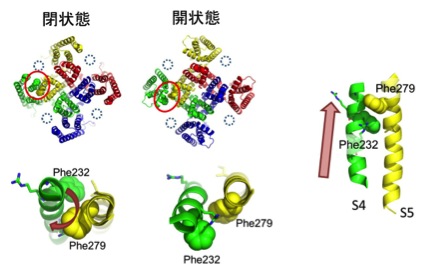
図:KCNQ1/KCNE1チャネル活性化時に2つのフェニルアラニン残基がぶつかる
電位依存性イオンチャネルが活性化するとき、すなわち閉状態から開状態に遷移するとき、電位センサーであるS4セグメントは回転しながら細胞外側に向かってスライドする。KCNQ1はS4セグメント上の232番目の位置にフェニルアラニン(Phe232)を有しており、KCNE1存在下においては、これが隣のサブユニットのS5セグメント上の279番目のフェニルアラニン(Phe279)とぶつかる。この立体障害により、KCNQ1/KCNE1チャネルが開きにくくなる。KCNE1が位置すると思われる場所は点線の○で示してある。