神経細胞間の接点「シナプス」の前末端に集積するシナプス小胞には神経伝達物質が高濃度に蓄積されており、この小胞がシナプス前末端の膜に融合することによって神経伝達物質が開口放出されることが良く知られています。伝達物質を放出後、小胞膜はエンドサイトーシスによって前末端内に回収され、シナプス小胞として再形成後、シナプス伝達に再利用されます。シナプスが高頻度の伝達を長時間維持するためには、シナプス小胞の開口と回収のバランスをとる仕組みが必要ですが、その詳細は明らかではありませんでした。今回、筆者らはラット脳幹の聴覚中継巨大シナプスcalyx of Heldにおいて、小胞の開口と回収をバランスさせる逆行性制御メカニズムを明らかにしました。この制御機構は、(i)伝達物質グルタミン酸によるシナプス後膜NMDA受容体の活性化、(ii) NOの産生、放出、(iii)シナプス前末端PKGの活性化、(iv) PIP2の動員、 (v)エンドサイトーシスの加速、という一連のシグナル連鎖によって作動することを突き止めました。この逆行性制御機構は、生後2週齢以降、PKGの発現上昇に伴って作動を開始し、高頻度入力を高信頼性に伝える高速シナプス伝達機能の生後発達に貢献するものと考えられます。
Eguchi K, Nakanishi S, Takagi H, Taoufiq Z, Takahashi T. Maturation of a PKG-dependent retrograde mechanism for exoendocytic coupling of synaptic vesicles. Neuron. 2012 Mar 10;74: 517-29.
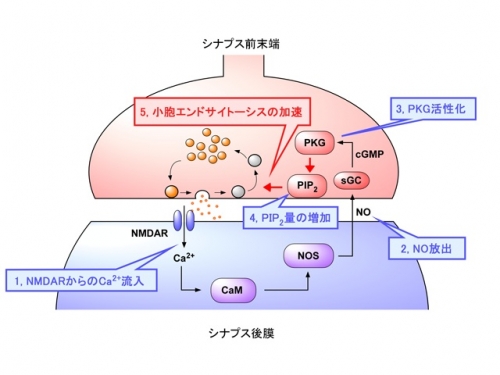
図の説明
一酸化窒素(NO)による逆行性シナプス制御機構 シナプス前末端から放出されたグルタミン酸は、シナプス後膜のNMDA受容体(NMDAR)に結合し細胞内へのカルシウムイオン流入を促します。流入したカルシウムイオンはカルモジュリン(CaM)を、CaMはNO合成酵素(NOS)を活性化し、NOを生成します。NOは細胞膜を透過してシナプス前末端へと拡散し、前末端にある水溶性グアニル酸シクラーゼ(sGC)を活性化します。sGCが活性化するとcGMPを生成し、cGMP依存性プロテインキナーゼ(PKG)が活性化します。活性化したPKGはPIP2濃度を制御することにより小胞エンドサイトーシスを促進します。このようにしてNO-PKG-PIP2経路による逆行性のシナプス制御が行われています。