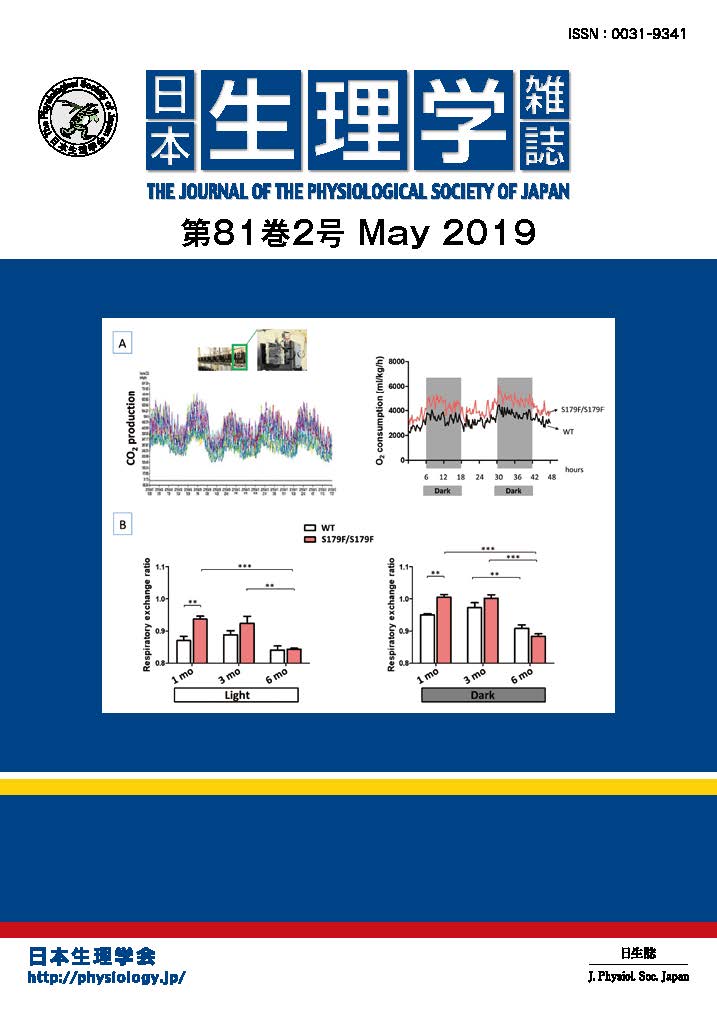
細胞は形態変化や分裂・移動、あるいは細胞死(アポトーシス)を起こす時、それに応じて自身の容積を適切に調節していますが、それは細胞内外への正味の水及び溶質の移動量を調節することで達成されています。細胞容積感受性外向整流性アニオンチャネル(VSOR)は、その際にCl–イオンやグルタミン酸等の陰イオン(アニオン)の移動を調節する主なものとして、あらゆる細胞に備わっていることが知られています。最近私たちは、そのVSOR活性化が細胞内Ca2+濃度上昇をもたらす個々のCa2+チャネル分子の極めて近傍で制御されうることを見出しました。マウス大脳皮質のアストログリアに炎症伝達物質のブラジキニンが作用するとVSORが活性化されますが、その活性化が細胞内Ca2+ストア上のIP3受容体、および細胞膜TRPC1チャネルの開口部近傍約20 nm以内に形成される高Ca2+濃度領域「Ca2+ナノドメイン」内での、Ca2+依存性リン酸化酵素PKCの活性化を通じて誘起されていることが判明しました(図)。この機構により、例えごく少量のブラジキニンが細胞の一部に作用して少数のCa2+チャネルのみ開いた場合でも、その周囲で確実に活性化シグナルが発生すると同時に、酵素系の介在によりCa2+チャネルが閉じた後もしばらくVSOR活性が維持されるため、この機構は細胞の局所的な容積調節、即ち形態変化や細胞間シグナル伝達の維持に重要な役割を果たしていると考えられます。(Akita & Okada, J Physiol 589(16):3909-3927, 2011)
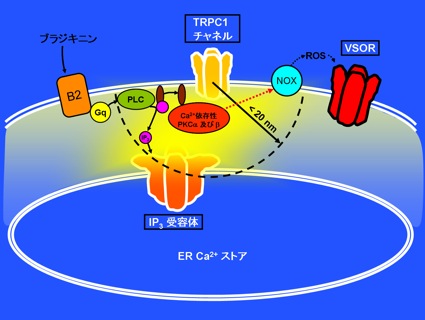
図の説明
ブラジキニンがアストログリア上のB2受容体に作用すると、Gq蛋白・ホスホリパーゼC(PLC)の活性化によりイノシトール3リン酸(IP3)が細胞内に生成されます。IP3は細胞内小胞体(ER)Ca2+ストア上のIP3受容体Ca2+チャネルを開口させ、それに続いて細胞膜のTRPC1チャネルも開きますが、それらの開口部から約20 nm(1 nmは100万分の1 mm)以内のCa2+ナノドメインで活性化されたCa2+依存性PKC及びが、活性酸素種(ROS)生成酵素NOXの活性化を通じて、VSOR活性化に関わっていることがわかりました。