2005年に海産無脊椎動物のホヤのゲノム情報から発見された電位依存性ホスファターゼVSPは、電気信号(細胞膜電位の脱分極)に応答して細胞膜の脂質量を変化させる(イノシトールリン脂質PI(4,5)P2の脱リン酸化酵素反応を示す)ユニークな酵素分子です。哺乳類まで保存されるVSPは、精子の成熟過程を通して酵素のはたらきを示しており、これが精子の運動制御に必須であると報告されてきました。しかしながら、VSPの持続的なはたらきを調節する分子機構は分かっていませんでした。
今回、分子動力学シミュレーションおよび蛍光を発するアミノ酸の一種Anapを組み込んだVSPで電位を変化させた際の蛍光強度の変化を調べました。これにより、電気信号を感知する電位センサーと酵素部位をつなぐリンカーに、脱リン酸化を受ける基質のPI(4,5)P2とは別のPI(4,5)P2が相互作用しており、この相互作用により酵素のはたらきが調節されることを明らかにしました。この結果は、PI(4,5)P2を介するネガティブフィードバック機構によってVSPが適度なはたらきを持続させていることを示しています。
Nonsubstrate PI(4,5)P2 interacts with the interdomain linker to control electrochemical coupling in voltage-sensing phosphatase (VSP). Mizutani N, Yonezawa Y, Nakagawa A, Okamura Y. Proceedings of the National Academy of Sciences of the United States of America 122(31): e2500651122, 2025.
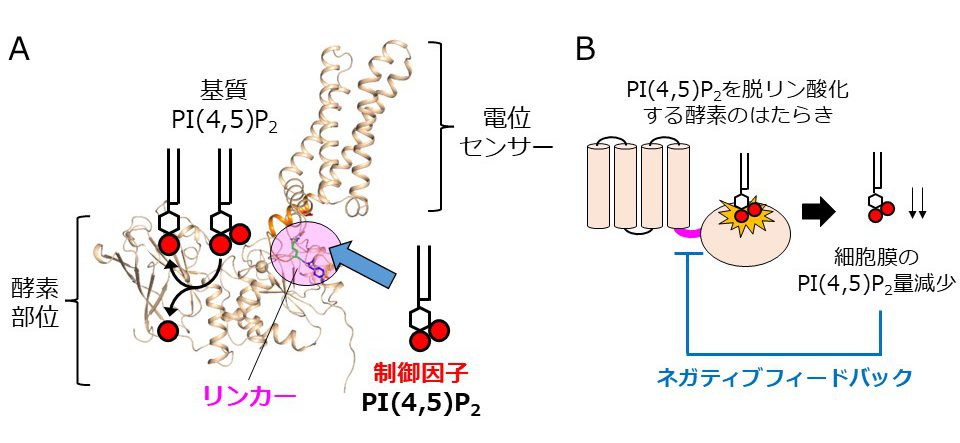
<図の説明>
基質とは別のPI(4,5)P2によるVSPの制御機構
(A)VSPは電気信号を感知する電位センサーとイノシトールリン脂質PI(4,5)P2を脱リン酸化する酵素部位からなる分子です。両部位をつなぐリンカーと基質とは別のPI(4,5)P2との相互作用によって酵素のはたらきが制御されることが分かりました。
(B)PI(4,5)P2を介するネガティブフィードバックは、酵素のはたらきが過剰になることを抑制し適切な強さを維持するための重要なメカニズムだと考えられます。