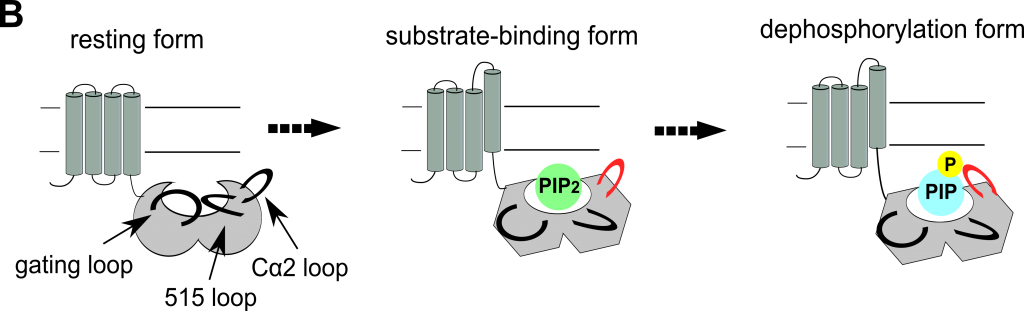
電位依存性ホスファターゼ(VSP)は電位センサー部分と細胞内領域である酵素ドメインで形成されており、細胞膜が脱分極すると電位センサーが動作して酵素活性を発揮します。酵素活性は酵素ドメインの立体構造変化が起こることで発揮されますが、実際に生きた細胞膜上に発現した膜タンパク質、特に細胞内側の立体構造変化を検出することは技術的な限界があり、これまでVSPのみならず、他の膜タンパク質でもほとんど報告がありませんでした。本研究では最近開発された蛍光を持つ非天然アミノ酸(Anap)を遺伝的にタンパク質のポリペプチド鎖に導入する技術を用いることで、細胞膜上に発現させたVSPの酵素ドメインに蛍光ラベルを導入し、膜電位依存的な構造変化を検出することに成功しました。Anapの蛍光シグナルを解析することで、酵素ドメインは電位センサーの動作に伴い少なくとも数ミリ秒以内に構造変化を起こし、しかも活性中心付近だけでなく酵素ドメインが一体となって動作すること、また細胞膜と酵素ドメインのFRETを計測することで酵素ドメインと細胞膜との距離は電位センサーが動作しても変化しないことが分かりました。さらにはAnapを酵素ドメインのCα2 loopと呼ばれる部分に導入した時にのみ、基質の濃度に依存した蛍光変化が観察されました。これらの結果を考え合わせますと、VSPは電位センサーが動作するとまず数ミリ秒以内に酵素ドメインの構造が変化することで基質が活性中心に結合し、その後Cα2 loopが稼働して酵素活性を発揮すると考えられます。細胞膜上に発現したVSPが膜電位依存的に酵素活性を発揮する仕組みを、立体構造変化の面から明らかにした、初めての研究です。
Voltage-dependent motion of the catalytic region of voltage-sensing phosphatase monitored by a fluorescent amino acid.
Sakata S*, Jinno Y, Kawanabe A and Okamura Y*. Proc Natl Acad Sci USA (2016) in press. *Corresponding authors
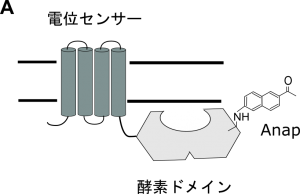
図A.細胞膜上に発現したVSPに非天然アミノ酸Anapを組み込んだ。
図B. VSPが膜電位依存的に基質を代謝する仕組み。
電位センサーが稼働すると酵素ドメイン全体の立体構造が変化して基質が活性中心に結合する(substrate-binding form)。その後Cα2 loopが動作して酵素活性が発揮される(dephosphorylation form)。