HCNチャネルは、過分極で開く電位依存性チャネルであり心臓のペースメーカー細胞や神経細胞に多く存在します。そのため、HCNチャネルが正常に働かないと、徐脈などの心疾患や、てんかんを引き起こすことがあります。近年のクライオ電子顕微鏡による構造解析などから、HCN4のS4が他の電位依存性チャネルと比較してかなり長いことがわかりましたが、この長いS4がチャネルのゲーティングにどのように関与するかは不明でした。一方で、この領域に含まれるR375やR378といった正電荷アミノ酸の変異が洞不全症候群や徐脈の原因となることは報告されていました。
今回我々は、HCN4チャネルの構造情報をもとに、S4の細胞外領域がS5セグメントおよびS1-S2リンカーの負電荷残基と塩橋を形成していることに着目しました。各種の変異体解析の結果、過分極時にS4がS5やS1-S2リンカーと段階的に塩橋を形成することで、HCNチャネルの電位依存性ゲーティングに寄与することがわかりました。R375は、塩橋形成に中心的な役割を担うため、変異によって塩橋形成が破綻することで、チャネル機能が低下し、そして疾患につながることがわかりました。
今回の結果は、長いS4の細胞外領域が電位依存性ゲーティングに重要な役割を果たすこと、そして塩橋形成の異常が疾患の発症メカニズムであることを示しており、将来的な治療標的としての検討につながることが期待されます。
Extracellular salt bridge networks around S4 implicated in HCN channel gating and heart disease. Kaei Ryu, Go Kasuya, Koichi Nakajo. Proceedings of the National Academy of Sciences of the United States of America 122(37): e2502136122, 2025
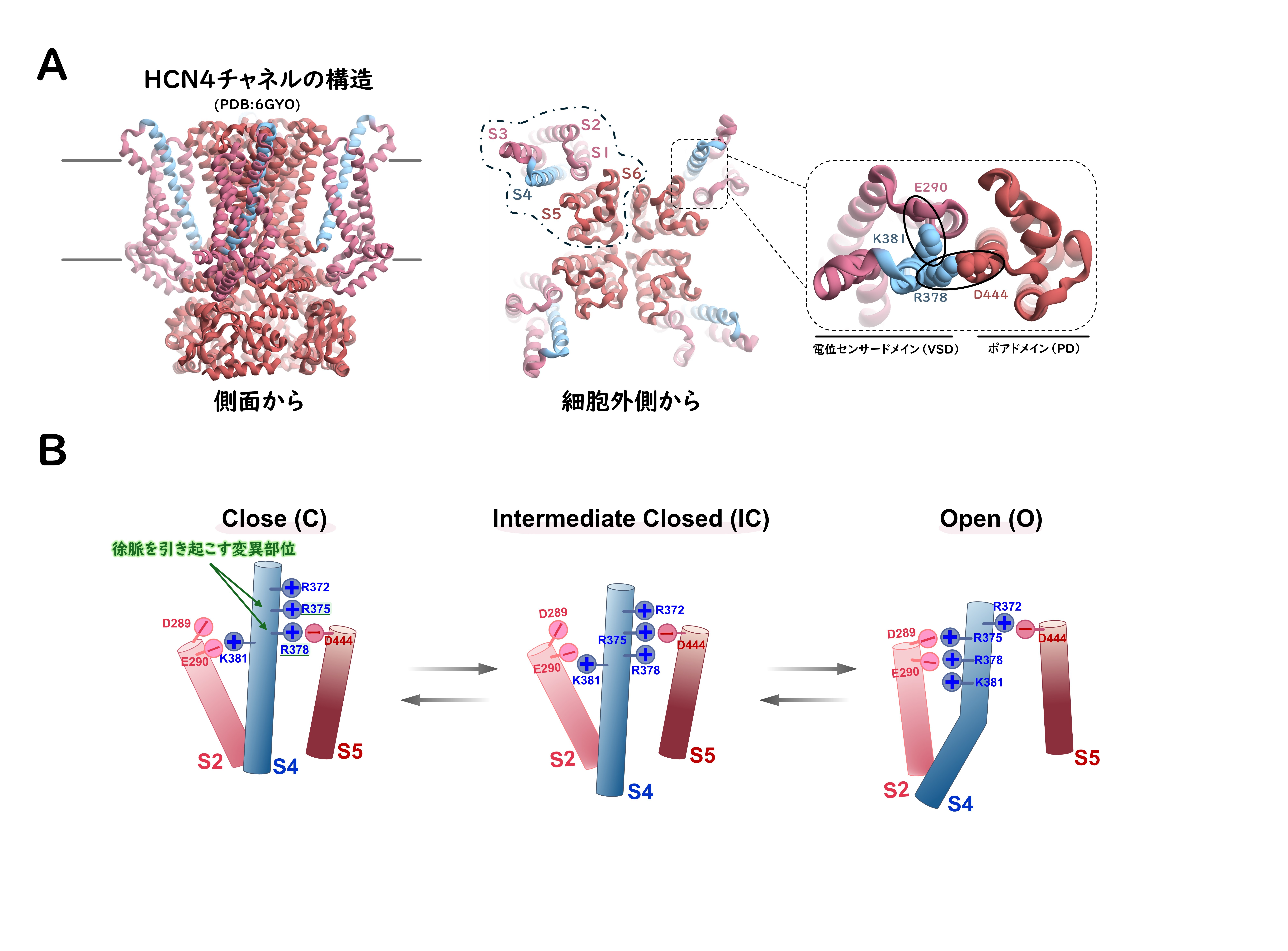
<図の説明>
(A)HCN4チャネルの閉状態の立体構造と塩橋の形成
クライオ電子顕微鏡によるHCN4チャネルの構造(PDB: 6GYO)。側面および細胞外側からの視点で描かれている。細胞外側に存在する正電荷アミノ酸残基(R378およびK381)が、S5およびS2セグメントに存在する負電荷アミノ酸残基(D444およびE290)と塩橋を形成している。
(B)HCNチャネルのゲーティングにおける塩橋形成の遷移
膜電位の変化に伴ってS4は順番に塩橋を組み換える。R375やR378に変異が生じると、塩橋ネットワークが破綻し、チャネルが開きにくくなることで徐脈や洞不全症候群などの疾患につながる。