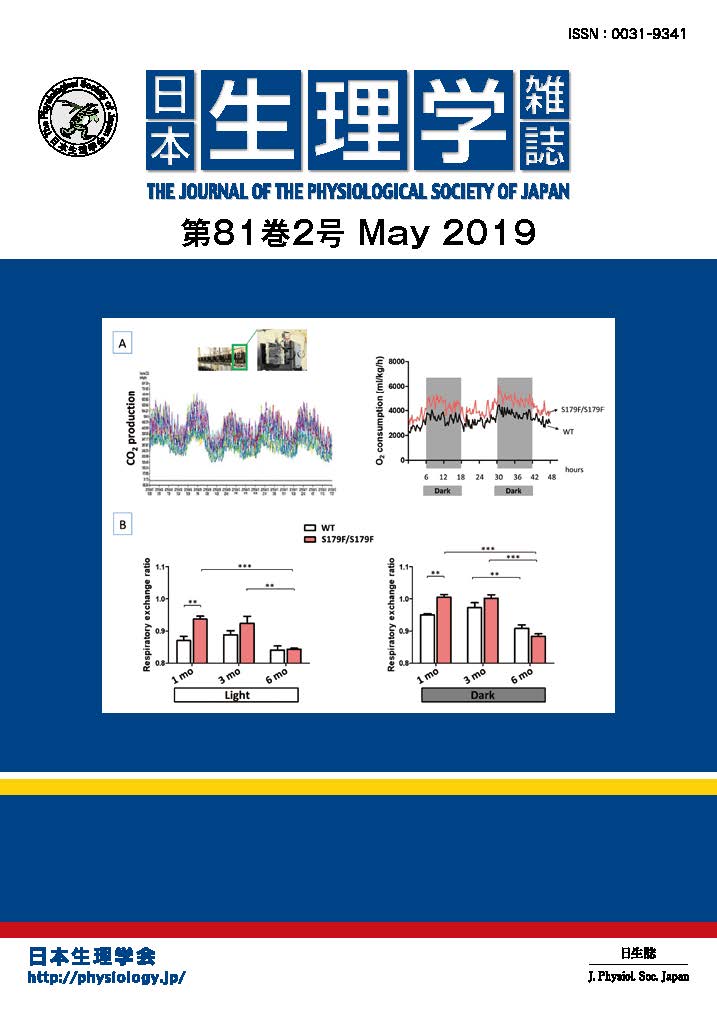
ミトコンドリア病はミトコンドリア機能障害を伴う希少難病である。しかし、発症に至る分子機構が不明であり、有効な治療法がない。我々はこれまでに、ミトコンドリアDNAによってコードされるtRNAに様々な化学修飾が存在することを明らかにした。今回の研究では、ミトコンドリア病患者で低下することが知られていたtRNA修飾の1つであるタウリン修飾の機能を新たに解明した。具体的には、(1)タウリン修飾欠損細胞では、ミトコンドリアの中でのタンパク質翻訳が停止し、ミトコンドリアの機能と構造が障害されていたが、ATP量は低下しなかった、(2)ミトコンドリアの形態異常により、本来ミトコンドリアに局在するはずのタンパク質が行き場を失い、やがて毒性の高い凝集体として細胞質に蓄積していた、(3)凝集体の形成を抑制する化合物をタウリン修飾欠損マウスに投与したところ、細胞毒性が低下し、ミトコンドリア病の症状が緩和した。これらのことから、タウリン修飾はミトコンドリアでのタンパク質翻訳に不可欠であり、ミトコンドリア病の実態は、従来考えられてきたエネルギーの代謝異常ではなく、タンパク質の機能異常であることが明らかになった。本研究結果は、ミトコンドリア病に対する新たな治療法の開発に寄与すると期待される。
”Defective mitochondrial tRNA taurine-modification activates global proteostress and leads to mitochondrial disease”
Md Fakruddin, Fan-Yan Wei, Takeo Suzuki, Kana Asano, Takashi Kaieda, Akiko Omori, Ryoma Izumi, Atsushi Fujimura, Taku Kaitsuka, Keishi Miyata, Kimi Araki, Yuichi Oike, Luca Scorrano, Tsutomu Suzuki, and Kazuhito Tomizawa
Cell Reports. vol. 22. 482-496, 2018
DOI: http://dx.doi.org/10.1016/j.celrep.2017.12.051
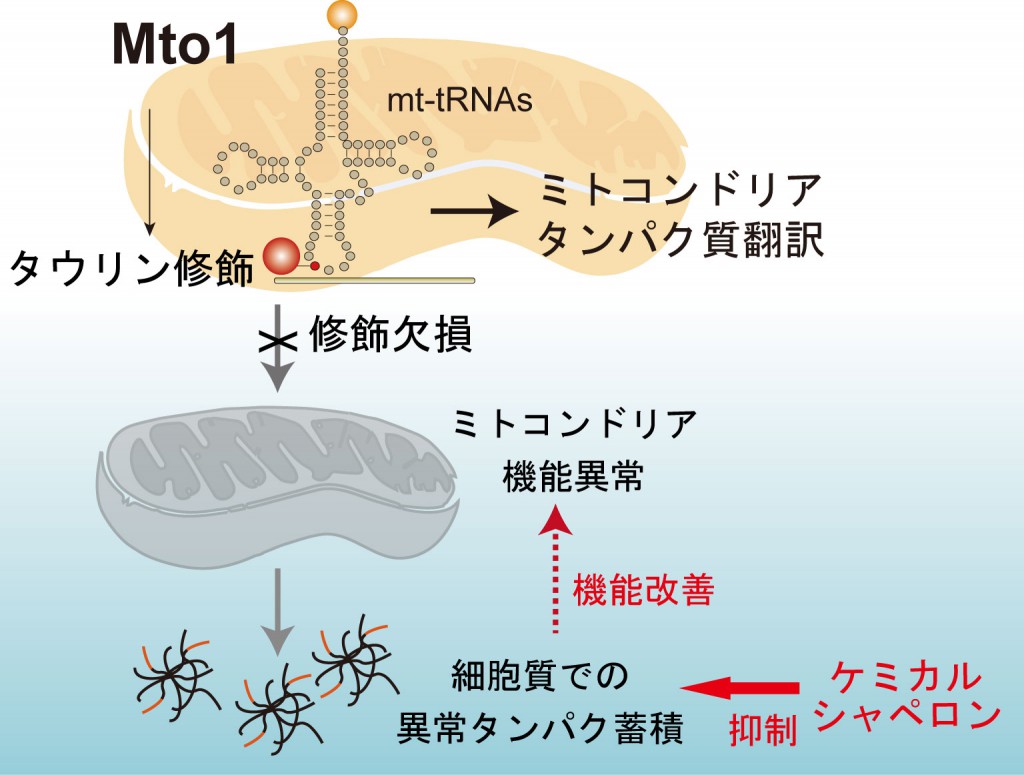
正常細胞のミトコンドリアでは、タウリンがtRNAと結合することで、タンパク質翻訳が正常に行われる。一方、タウリン修飾が低下しているミトコンドリアでは、ミトコンドリアの中でタンパク質翻訳が止まり、ミトコンドリアの構造が崩壊する。その結果、ミトコンドリア局在するはずのタンパク質が行き場を失い、凝集体となって細胞にダメージを与える。ケミカルシャペロンを投与すると、異常タンパク質の蓄積が抑制され、細胞機能が回復する。